Имплантация спинальных (эпидуральных) порт-систем.
Имплантация спинальных (эпидуральных) порт-систем.
Методические рекомендации
Хроническая боль – проблема, с которой, по данным ВОЗ, встречается треть населения Земли. Хронической называют длительно существующую (более 3 месяцев) боль, связанную с заболевания различной природы и локализации. По предложению Международной ассоциации по изучению боли [IASP, 1994] боль формулируется, как «неприятное сенсорное и эмоциональное ощущение (переживание), связанное с состоявшимся или потенциальным повреждением или описываемое в терминах такового».
По данным ВОЗ треть населения планеты страдает от хронической боли. Чаще всего людей беспокоит боль в спине, основной причиной которой являются дегенеративно-дистрофические изменения позвоночника – межпозвонковых дисков и дугоотростчатых суставов, с последующим вовлечением в процесс связок, мышц, сухожилий и фасций [1]. Факторами риска развития неспецифических болей в спине являются: трудоспособный возраст (период интенсивной рабочей нагрузки на позвоночник), избыточный вес, профессиональная деятельность (тяжелая физическая работа, неподвижная статическая нагрузка на позвоночник, вибрация, монотонный физический труд), аномалии развития скелета (асимметрия тела, спондилолиз, люмбализация) [2].
К не менее актуальной проблематике относится и онкологическая боль. По самой скромной оценке более 3,5 миллионов человек в мире ежедневно мучаются от раковой боли, а у 50% из них болевое ощущение оценивается, как сильное или очень сильное [3]. Основными причинами болевых ощущений при онкологических заболеваниях являются: сама опухоль, которая вызывает вовлечение болевых афферентов различных органов и тканей (поражение костей, мягких тканей, кожи, внутренних органов, окклюзию сосудов и органов пищеварительного тракта и др.). Во-вторых, осложнения опухолевого процесса (патологический перелом, некроз, изъязвление, воспаление, инфицирование тканей и органов, тромбозы). В третьих: последствия астенизации (пролежни, трофические язвы, запоры), и наконец, в четвертых: противоопухолевое лечение само становится источником сильнейших болевых реакций [4]
Современный подход к лечению болевых синдромов построен на так называемой «лестнице ВОЗ». Суть метода заключается в пошаговой стратегии назначении препаратов различных фармакологических групп и интервенционных методов лечения в зависимости от степени выраженности болевого синдрома [6]
Так на первой ступени, при лечении боли слабой интенсивности, назначают ненаркотические анальгетики. Прежде всего, это НПВП различных групп[5].
Неэффективность применяемой фармакотерапии на этом этапе, при усилении болевого синдрома до средней степени интенсивности, является показанием к переходу на более высокую ступень, т.е. подключение к проводимой терапии слабых опиоидов, к которым относят трамадол и кодеин [11].
В основном, эта стратегия применяется при онкологических заболеваниях.
При боли высокой интенсивности, происходит переход на третью ступень «лестницы ВОЗ», где используются сильнодействующие наркотические анальгетики — бупренорфин, морфин и фентанил, в виде инъекций и трансдермальных форм [7].
Использование всех вышеперечисленных фармакологических групп имеет ряд побочных эффектов, которые существенно ограничивают их применение. Так при использовании НПВС возникает высокий риск желудочно-кишечных кровотечений, агранулоцитоза, развития острой почечной и печёночной недостаточности, обострения бронхиальной астмы [8].
Таблетированные опиоиды, в частности, трамал, требуют частого приема (каждые 3,5-4 часа) и обладают неблагоприятным профилем безопасности (тошнота, рвота, запоры) [11]. Инъекционные опиоиды требуют такого же частого применения (причем инъекции сопровождаются болью). Использование трансдермальных форм характеризуется быстрым развитием толерантности, нарушениями сна, дневной активности пациента [10]
Кроме того, сложность назначения, хранения, учёта наркотических анальгетиков и приравненных к ним препаратов, заставляет искать альтернативные методы и средства лечения болевых синдромов. К подобным средствам справедливо можно отнести нейроаксиальные блокады: спинальные и эпидуральные [9].
Регионарные методы обезболивания нашли широкое применение в хирургической практике как компоненты анестезии, а в дальнейшем, как эффективные методики послеоперационной аналгезии пациентов. Использование катетеров для введения местных анестетиков позволяет длительно блокировать болевую им пульсацию, идущую от периферии к центральным нервным структурам (Рис.1)
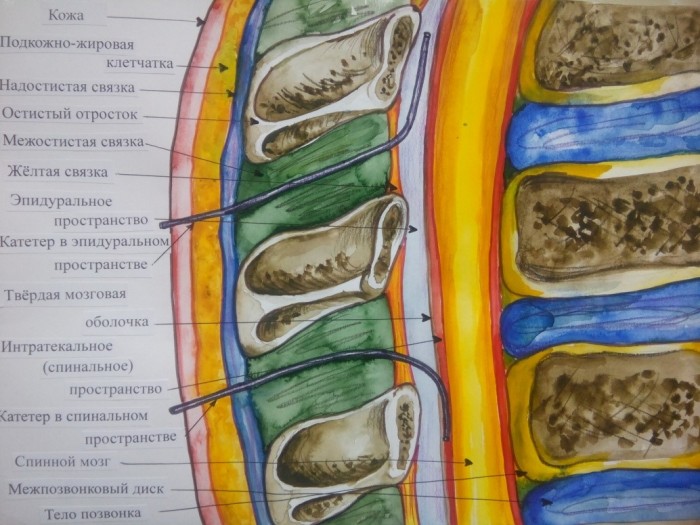
Рис.1 Анатомические структуры спины в разрезе, с эпидуральным и спинальным катетерами.
Однако, есть один недостаток этих методов: невозможность использования их вне стационара, так как выведенный наружу катетер является входными воротами инфекции даже при самом тщательном уходе за ним. Имплантируемые порт-системы, являются прекрасной альтернативой для частого и длительного введения лекарственных средств пациентам вне стационара. Использование порт-систем особенно целесообразно у пациентов с инкурабельными онкологическими заболеваниями, сопровождающимися тяжёлым болевым синдромом, который плохо купируется традиционными лекарствами.
Показания и противопоказания
Показания для постановки эпидуральных порт-систем:
- Выраженный болевой синдром, связанный с раздражением спинномозговых корешков, плохо купируемый медикаментозно, при неэффективности лечебных блокад и радиочастотной абляции (РЧА) нервных структур.
- Дегенеративный стеноз позвоночного канала с неврологической клиникой.
- Постгерпетическая и диабетическая нейропатия, не купируемая другими средствами.
- Фантомные боли в ампутированной конечности, не купируемые медикаментозно.
- Облитерирующие заболевания нижних конечностей.
Показания для постановки спинальных порт-систем:
- Выраженный болевой синдром у онкологических больных, при отсутствии эффекта от рутинной терапии, включающей наркотические анальгетики.
- Отказ пациента от консервативной терапии.
- Опиоид-индуцированная гипералгезия.
Противопоказания к применению спинальных (эпидуральных) порт-систем:
- Пациенты в агональном и предагональном состоянии.
- Отсутствие возможности соблюдения правил ухода за имплантированным устройством.
- Отказ пациента от постановки порт-системы.
- Воспалительный процесс в зоне проведения предполагаемой имплантации.
Материально-техническое обеспечение новой медицинской технологии
- Процедура должна проводиться в операционной с соблюдением правил асептики и антисептики.
- Во время вмешательства обязателен мониторинг витальных функций, включающий в себя пульсоксиметрию, неинвазивное измерение артериального давления, ЭКГ в двух отведениях.
- Местные анестетики, например, 2% раствор лидокаина и 0,75% раствор ропивакаина.
- Спинальная (эпидуральная) порт-система для имплантации.
Описание медицинской технологии
Процедура проводится в условиях операционной.
Накануне пациенту выполняется очистительная клизма. В день операции устанавливается периферический внутривенный катетер и проводится инфузия кристаллоидных растворов в объёме 500-1000 мл.
Имплантация порт-системы
Больной находится в положении на боку, с приведёнными к груди коленями, максимально согнутой спиной. Кожа спины обрабатывается антисептическими растворами по общепринятым хирургическим правилам. Операционное поле изолируется стерильным материалом.
В предполагаемом месте пункции (обычно уровень L3 — L5 для спинальных и Th8-L5 для эпидуральных портов) вдоль остистых отростков под местной анестезией делается разрез кожи длиной 2-4 см. Кожа отсепаровывается и формируется карман для «держателя» катетера размером 2 см. Проводится пункция иглой Tuohy 18 G, входящей в набор порт-системы, на этом уровне. Эпидуральное пространство идентифицируется путем пробы «потери сопротивления», специальный шприц входит в набор порт-системы (Рис.2). Если целью постановки катетера является эпидуральное пространство, дальнейшее продвижение иглы прекращается. При катетеризации спинального пространства игла проводится далее, до момента появление ликвора в павильоне иглы.
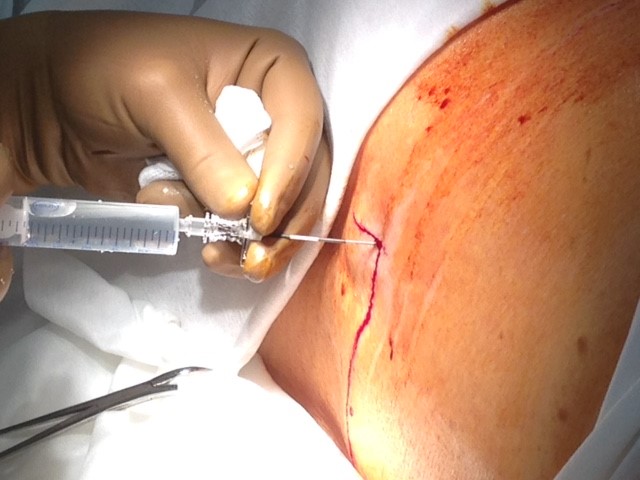
Рис. 2. Пункция эпидурального пространства
Через иглу Tuohy устанавливается полиуретановый катетер с металлическим мандреном. Катетер продвигается до тех пор, пока он не достигнет конца иглы. Производится заведение катетера с мандреном на глубину до 5 см в спинальное пространство ниже места пункции. Срез иглы Tuohy, при этом, должен быть направлен дистально. Для определения длины на катетере имеются метки, через каждые 5 см. При пункции эпидурального пространства направление введения катетера может быть разным (в зависимости от локализации источника болевого синдрома). Далее, металлический мандрен извлекается. Правильность положения конца катетера в спинальном пространстве определяется ликвореей из проксимального конца катетера. Игла Tuohy извлекается, придерживая катетер в фиксированном положении.
К месту выхода наружу одевается фиксатор (держатель) катетера, устройство, предотвращающее перегиб катетера. «Держатель» погружают в сформированный «карман» и пришивают за «ушко» к фасции при помощи швов (Рис. 3)
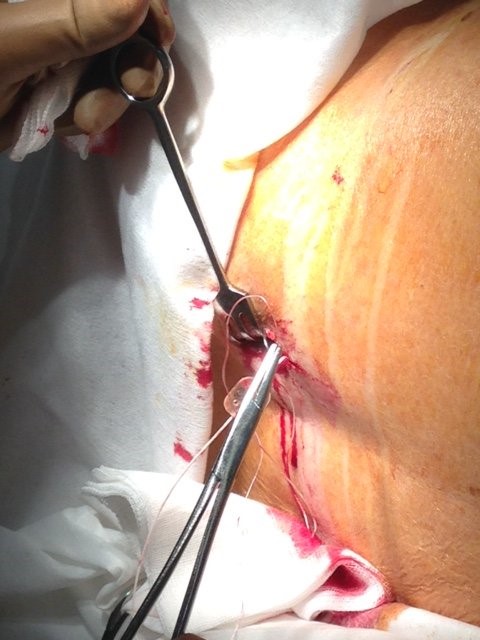
Рис. 3. Подшивание «держателя» катетера
Далее, в месте пересечения задне-аксилярной линии и 11-12 ребра, в зоне имплантации камеры порт-системы осуществляется инфильтрация кожи и подлежащих тканей раствором местного анестетика для обезболивания. После этого производится разрез кожи и подкожно-жировой клетчатки длиной в 4-5 см. Тупым способом в подкожно-жировой клетчатке формируют «карман» для камеры, так чтобы она нижней поверхностью опиралась на основание ребра.
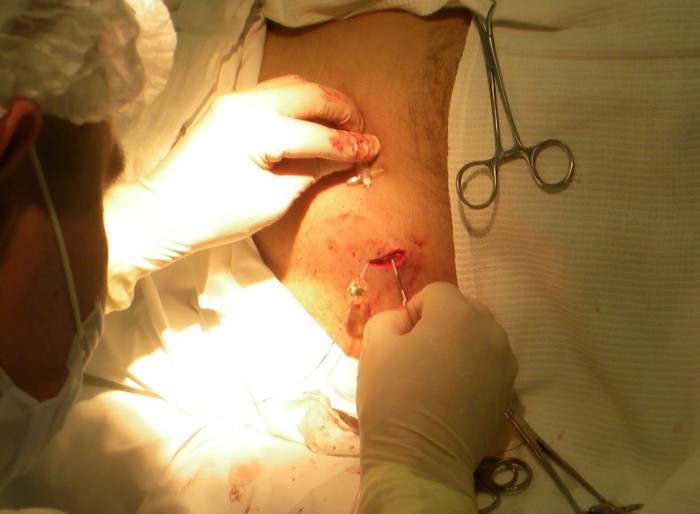
Проводится местная анестезия кожи от места выхода катетера на поверхность до места стояния камеры порт-системы. Катетер насаживается на металлический проводник – туннелизатор, которым в несколько приёмов, осуществляют проведение катетера через кожу к камере порт-системы (Рис. 4). Катетер обрезается ножницами под прямым углом на необходимую длину. При этом оставляют небольшой «люфт», рассчитанный на движение пациента (обычно 1-2 см).
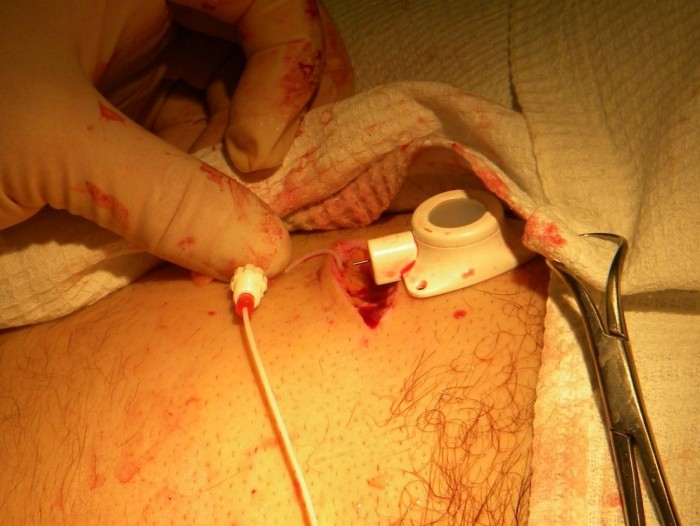
Соединительная муфта отодвигается проксимально по катетеру, его кончик вставляется в выходную канюлю камеры порта (Рис.5)
 |
 |
|
Рис. 4. Проведение катетера к месту соединения |
Рис. 5. Соединение катетера с камерой |
Затем присоединяется соединительная муфта и затягивается винтовым механизмом, сначала вручную, затем, с помощью ключа, входящего в набор (Рис.6)
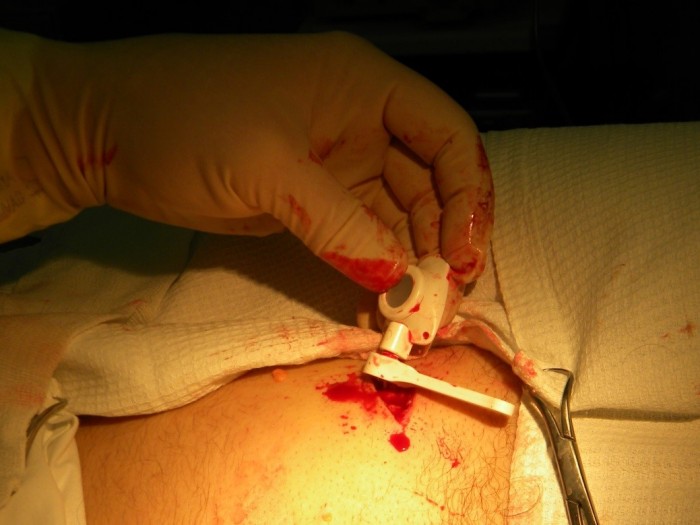
Рис.6 Фиксация катетера с камерой порт-системы с помощью ключа
Необходимо, чтобы катетер был прочно фиксирован с камерой, но при этом, не был перетянут, то есть оставался проходим для применяемых препаратов. Проходимость порт-системы проверяют введением физиологического раствора в объёме 1-2 мл шприцом 10-20 мл, через прямую иглу Губера, входящую в набор. Раствор должен проходить под некоторым сопротивлением, в течение 10-20 секунд (Рис. 7)
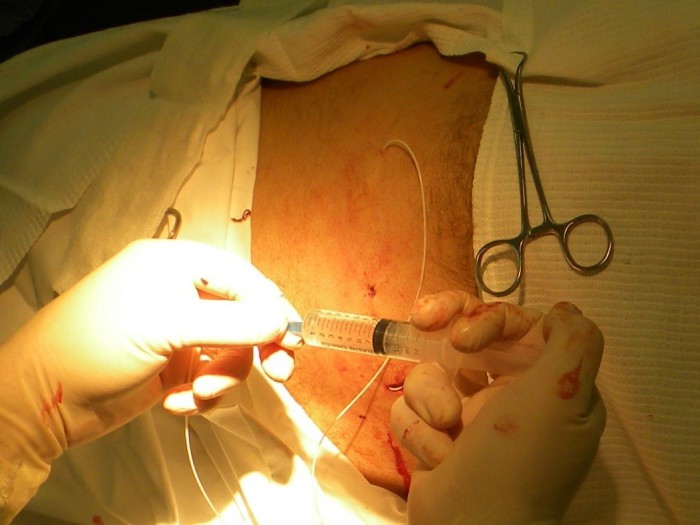
Рис.7 Проверка проходимости катетера
При этом, проверяется герметичность системы на всех уровнях. Камера погружается в «карман», подшивается к окружающим тканям. При этом необходимо убедиться, что место разреза не приходится на мембрану камеры порт-системы. Швы на кожу. Асептическая повязка. Ушивание раны «держателя» катетера на спине. Наложение асептической повязки.
Проводится проба на идентификацию интратекального пространства, введением 2%- раствора лидокаина- 2,0 мл. При этом, отмечается незначительное снижение АД (САД и ДАД) на 10-20 мм.рт.ст., и эффект обезболивания, продолжающийся 1-2 часа (Рис.8)
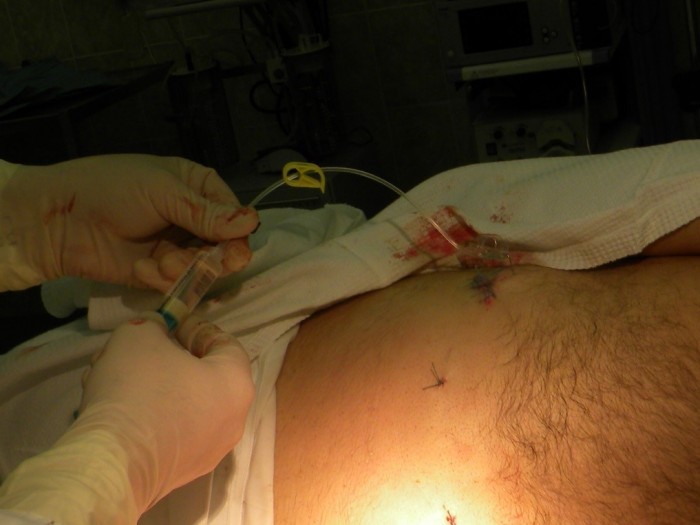
Рис. 8 Проба на идентификацию интратекального пространства
Во время всей процедуры проводится инфузия кристаллоидных растворов 500 мл/час. После операции пациент наблюдается в течение часа на отделении, и в случае стабильного состояния транспортируется из стационара.
Эксплуатация порт-системы
При работе с порт-системами важно соблюдать принципы асептики и антисептики, чтобы предотвратить инфекционные осложнения и последующие нарушения функции ЦНС.
При осмотре места имплантации обращайте внимание на состояние кожных покровов, отсутствие признаков воспаления, с помощью пальпации исключите смещение камеры порт-системы.
Необходимо проводить измерение артериального давления и пульса на всех этапах эксплуатации: перед введением анестетика, через пять минут после введения анестетика при болюсном введении, через каждые 20 минут при инфузионном введении.
Кожу над камерой обрабатывают раствором кожного антисептика. В стерильных перчатках заполняется физиологическим раствором «г-образная» игла Губера с удлинителем. Удерживая камеру порта, перпендикулярно поверхности кожи, вводится подготовленная игла в мембрану камеры до ощущения упора в дно камеры, что сопровождается характерным металлическим звуком. Открыв зажим удлинителя иглы, вводится 1-2 мл раствора. Раствор, при этом, должен проходить с видимым сопротивлением, в течение 20-40 секунд. При эпидуральном введении у пациента может появиться ощущение «холодка» или «текущей воды», что говорит о правильном расположении катетера.
При эпидуральном положении катетера, есть опасность попадания его кончика в венозное сплетение, поэтому перед введением местного анестетика необходимо провести аспирационную пробу.
После промывки, осуществляется основная процедура — обезболивание, которое может проводиться в двух режимах: болюсно и с помощью эластомерной помпы, к примеру: Easypump фирмы BBraun (Германия). Для длительного обезболивания рекомендованные местные анестетики: лидокаин, ропивакаин. Для болюсного введения дозы препаратов в среднем составляют: для лидокаина 80 ±20 мг, наропина – 30 ± 10 мг при эпидуральном введении; при интратекальном использовании для лидокаина 20±5 мг и наропина 6±2 мг. При эксплуатации эластомерной помпы с блоком контроля скорости инфузии от 2 до 14 мл/час, проводится обезболивание пациентов при помощи препарата Наропин 0,2% – 200 мл. Скорость введения пациенты могут регулировать самостоятельно, согласно их ощущениям и индивидуальной переносимости местных анестетиков.
По окончанию процедуры «г-образную» иглу Губера с удлинителем перекрывают зажимом-клипсой, выход закрывают винтовой крышкой. «Крылышки» иглы фиксируют к коже пластырем, сверху накладывается стерильная повязка. Подобная игла может находиться в камере порт-системы без последующей замены 4-5 дней.
Возможные осложнения и способы их устранения
Закупорка порт-системы
В первую очередь необходимо убедиться, что зажим-клипса открыт и весь удлиннитель иглы проходим. При отсутствии проходимости, необходимо извлечь иглу и повторить попытку её введения рядом. Обращает на себя внимание необходимость пройти всю толщу мембраны камеры порт-системы, до момента появления упора, иначе введение препаратов будет невозможно.
Если пациент находится в кровати на спине, часто мягкий полиуретановый катетер придавливается в месте соединения с «держателем», поэтому, при отсутствии проходимости в этом случае, необходимо попросить пациента перевернуться на бок или сесть.
При отсутствии проходимости необходимо решать вопрос об удалении нефункционирующей порт-системы.
Нарушение целостности порт-системы
При использовании шприцов малого объёма (2-5 мл), в момент введения препаратов создаётся высокое давление в системе, и катетер может отсоединиться от камеры. Для предупреждений подобного осложнения необходимо использовать шприцы большего объёма (не менее 10 мл) и надёжно фиксировать иглу к коже пациента в момент болюсного введения препаратов.
Нарушение герметичности порт-системы
Многие пациенты, которым имплантируется порт-система, вынуждены находиться в постели вследствие основного заболевания. При малоподвижном образе жизни, существует опасность мацерации кожи в отлогих местах спины, вплоть до появления пролежней. Нарушение целостности кожных покровов может приводить к выпадению катетера, иногда и «держателя» с катетером (Рис. 9). В подобной ситуации, необходимо без промедления удалить порт-систему, чтоб предотвратить инфицирование эпидурального или спинального пространства.
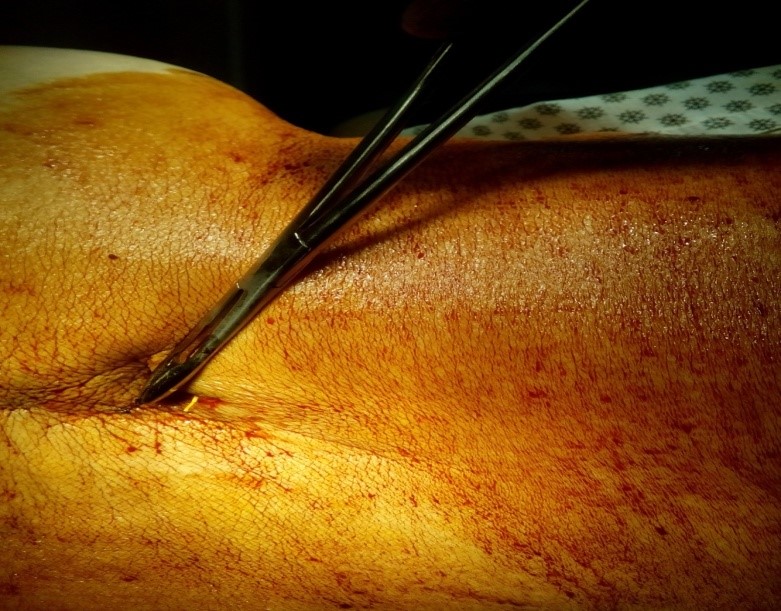
Рис. 9. Нарушение герметичности порт-системы: выпадение катетера
Инфицирование порт-системы
Для предупреждения инфицирования порт-систем, необходимо на этапе планирования операции оценить тяжесть состояния самого пациента, возможность его и родственников правильно пользоваться имплантированным устройством, соблюдать правила асептики и антисептики.
Необходимо оценить состояние кожных покровов пациента.
Операция должна проводиться в асептических условиях операционной. При наличии неблагоприятных сопутствующих факторов, необходимо проводить антибиотикопрофилактику. В случае нарушения герметичности, отсутствии проходимости, появления признаков воспаления в проекции камеры и (или) «держателя» порт-системы, необходимо немедленно удалить порт-систему и проводить общепринятые меры, направленные на предупреждение генерализации процесса (хирургическая обработка ран, инфузионная и антибактериальная терапия).
Эффективность использования спинальной (эпидуральной) порт-системы
В работе проанализирован уровень анальгезии у 19 пациентов с различными, заболеваниями, которым были имплантированы спинальные (эпидуральные) порт-системы BBraun Celsite ST – 304 (Германия) на базе СПб ГБУЗ «Городская больница №40» (г. Сестрорецк). В дальнейшем, пациенты находились в амбулаторных условиях, с контрольными явками в стационар. Время проведения: 2014 — 2016. Средний возраст пациентов составил 65,5 ± 6,3 года. Женщин — 9 (47%), мужчин 10 (53%). Распределение по патологии: дегенеративно-дистрофическое заболевание позвоночника (ДДЗП) — 3 человека, постгерпетическая нейропатия — 1 человек, рак кишечника — 8 человек, рак поджелудочной железы — 4 человека, рак яичника — 2 человека, рак желудка — 1 человек
Оценку боли осуществляли по визуальной аналоговой шкале (ВАШ) от 0 до 10, где 0 — отсутствие болей, 10 — нестерпимая боль. На момент постановки порт системы у пациентов исследуемой группы уровень боли был 8±1 по ВАШ.
У 6-ти пациентов была проведена катетеризация эпидурального пространства, с заведением кончика катетера на 5 см краниальнее точки пункции (точка пункции Th10 – Th12). У 13-ти пациентов была проведена пункция на уровне L3-L5, с катетеризацией интратекального пространства и заведением кончика катетера каудальнее на 5 см.
При эксплуатации порт-систем у трёх пациентов болевой синдром был полностью купирован, у восьмерых снизился до приемлемых цифр: 3-4 балла по ВАШ, а у оставшихся восьмерых снизился до цифр 5-6 по ВАШ. Кроме того, не было ни одного пациента, испытывающего нестерпимую и очень сильную боль (8 -10 баллов по ВАШ), которая присутствовала до применения порт-систем у двух пациентов с раком поджелудочной железы.
Длительность болюсного обезболивания при эпидуральном введении была больше почти в два раза по сравнению со спинальным доступом. В свою очередь, болюсное введение анестетиков по сравнению с комбинированным путём было меньше в 3 и 4 раза при эпидуральном и спинальном пути введения соответственно. При использовании эластомерной помпы обезболивание на уровне 3-6 баллов по ВАШ осуществлялось в течение почти 12 часов, с дальнейшей необходимостью увеличения скорости введения или дополнительного болюсного введения. Значительной разницы в длительности анальгезии между спинальным и перидуральным введением с помощью эластомерной помпы – не выявлено.
При работе с порт-системами возникали сложности, связанные, в-основном, с эксплуатацией конструкции. Так у двух пациентов, с появлением пролежней на спине, произошло выпадение наружу «держателя» катетера, что потребовало удаления всей системы. У одного пациента в проекции камеры порта возник абсцесс, ещё у одного больного нарушилась проходимость порта, что в обоих случаях потребовало удаления всей конструкции.
Отмечается, что все побочные явления связаны с действием местных анестетиков на структуры спинного мозга, поскольку при нейроаксиальной анестезии происходит блокирование преганглионарных волокон симпатической нервной системы, что ведёт к снижению тонуса сосудов, депонированию части ОЦК в ёмкостных сосудах, снижению венозного возврата и уменьшению сердечного выброса. Кроме того, у большинства пациентов наблюдалась относительная гиповолемия на фоне основного заболевания, всё это приводило к гемодинамическим сдвигам в виде снижения артериального давления и уменьшения частоты сердечных сокращений. При этом, изменения гемодинамики во всех случаях носили мягкий и управляемый характер: наблюдалось спонтанное восстановление артериального давления через 20-30 минут, а в случае инфузионной поддержки — через 10 — 15 минут до исходных цифр. Моторный блок наблюдался при использовании малых доз анестетиков у 4-х пациентов со спинальными порт-системами. У двух больных отмечалась диарея, возможно, обусловленная основным заболеванием, но точно утверждать, как и опровергать эти данные не представляется возможным из-за малого количества наблюдений.
Случаев возникновения депрессии дыхания ни у одного из пациентов основной группы отмечено не было.
Заключение
- Имплантируемая спинальная (эпидуральная) порт-система обеспечивает, возможность быстрого и длительного обезболивания пациентов с выраженным болевым синдромом различного происхождения, как в стационаре, так и вне его.
- Имплантированная порт-система не обременительна для пациента. Она не только не ограничивает его образ жизни, но и способствует улучшению его качества, снижая болевые ощущения.
- Для использования порт-системы не требуются специальные медицинские знания, наличие сложного оборудования. Обучение работе с ней занимает несколько минут. Однако в дальнейшем, требуется эмпирически и индивидуально подбирать дозу, темп и скорость введения. Всё это даёт возможность пациенту и его родственникам активно влиять на ситуацию.
- При соблюдении правил ухода и рекомендованных дозировок препаратов порт-система безопасна для пациента. Материалы, из которых она изготовлена являются биологически инертными, не вызывают негативных реакций со стороны организма и не взаимодействуют с лекарственными препаратами.
- Предпочтение оказывается комбинированному пути введения анестетиков, с помощью эластомерной помпы, как базовой методике, дополняя её болюсным введением препарата по требованию.
Литература
- Алексеев В.В., Баринов А.Н., Кукушкин М.Л. и др. Боль: руководство для врачей и студентов / под ред. Н.Н. Яхно. – М., МедПресс, 2009. – 302 с.
- Данилов А.Б., Жаркова Т.Р. Хроническая радикулопатия: новые возможности терапии // Русский медицинский журнал. Специальный выпуск «Болевой синдром». – 2010; 18: 15–19.
- «Злокачественные новообразования в России в 2013 году. Заболеваемость и смертность» Под редакцией А. Д. Каприна, В. В. Старинского, Г. В. Петровой, Москва, 2015.
- Паллиативная помощь онкологическим больным. Пособие для врачей. – М., 2000.
- Agency for Health Care Policy and Research. Clinical practice guideline. Management of cancer pain. Available at: http://www.painresearch.utah.edu/cancerpain/guidelineF.html.
- Beaulieu P., Lussier D., Porreca F., Dickenson A. H. Pharmacology of pain. IASP Press 2010, 622 p.
- Jost L., Roila F. Management of cancer pain: ESMO Clinical Practice Guidelines Annals of Oncology 21 (Supplement 5): V.257–260. – 2010. URL: http://annonc.oxfordjournals.org/content/21/suppl_5/v257.full.pdf
- Nersesyan H, Slavin KV. Current approach to cancer pain management: availability and implications of different treatment options. The Clin. Risk Manag. 2007; 3: p. 381–400. URL: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2386360/pdf/tcrm-0303-381.pdf
- Nessa Coyle and Myra Glajchen. Pain Management in the Home: Using Cancer Patients as a Model // Practical Management of Pain / Benzon H.T. et al. 2014. 5th ed. Ch 78, 1040–1048. ISBN-10: 0323083404 ISBN-13: 978-0323083409
- Use of Opioid Analgesics in the Treatment of Cancer Pain: Evidence-based Recommendations from the EAPC / Caraceni A. et al. // Lancet Oncol. — 2012. Vol 13, No 2. P. 58–68. URL: http://www.moltenifarma.it/wp-content/uploads/2015/07/Linee-guida-EAPC.pdf
- Wool MS, Mor V. A multidimentional model for understanding cancer pain. Cancer Invest. 2005. Vol 23, No 8. P.727–734.
